Vol. XXXI Issue 2
Article 4
DOI: 10.35407/bag.2020.31.02.04
ARTÍCULOS ORIGINALES
Higroma quístico y la importancia de su diagnóstico prenatal: a propósito de un caso
Cystic hygroma and the importance of the prenatal diagnosis: about a case
Almonacid I.1
Zuleta P.2
Neri C.2
Zannin A.2
Garzón M.2
Dorado J.2
Medina F.3
Celis L.G.2 *
1 Departamento de Patología, Hospital Central de la Policía, Bogotá, Colombia;
2 Facultad de Medicina, Universidad de la Sabana, Bogotá, Colombia;
3 Departamento de Radiología, Hospital Militar Central, Bogotá, Colombia.
* Corresponding author: Luis Gustavo Celis luis.celis@unisabana.edu.co
ORCID 0000-0002-0338-6258
RESUMEN
El higroma quístico es la malformación del sistema linfático que más frecuentemente se observa en el período prenatal y que se ubica principalmente en el cuello y/o la nuca. Su tasa de detección ha aumentado desde la implementación de la translucencia nucal fetal (TN) en el primer trimestre de embarazo, y su presencia se ha relacionado con anomalías congénitas, aneuploidías, pérdida del embarazo y trastornos en el desarrollo. El objetivo de la presentación de este caso es resaltar la importancia del diagnóstico antenatal del higroma quístico, con el fin de realizar una intervención precoz y evitar la muerte fetal. Se recibe para estudio anatomopatológico, feto de sexo indeterminado producto del primer embarazo de una madre de 19 años de edad sin previos controles prenatales, con presencia de una gran masa quística que se extiende desde el rostro hasta la nuca. Mediante el estudio histológico se confirma el diagnóstico de higroma quístico. Al carecer de análisis de cariotipo no fue posible establecer la preexistencia de alguna anomalía genética. El también conocido como linfangioma quístico, es un tumor vascular benigno cuyo diagnóstico antenatal mediante la ultrasonografía resulta fundamental en la evolución y pronóstico de la enfermedad. Desafortunadamente en nuestro caso, la falta de controles prenatales y la ausencia de estudios ultrasonográficos que permitieran conocer las características de este linfangioma, pudo impactar significativamente en el desenlace fatal.
Palabras clave: Linfangioma; Diagnóstico prenatal; Translucencia nucal fetal
ABSTRACT
The cystic hygroma is the malformation of the lymphatic system that is most frequently observed in the prenatal period and is located mainly in the neck and/or the nape of the neck. Its detection rate has increased since the implementation of fetal nuchal translucency (NT) in the first trimester of pregnancy and its presence has been associated with congenital abnormalities, aneuploidies, pregnancy loss, and developmental disorders. The aim of this case is to highlight the importance of antenatal diagnosis of cystic hygroma in order to perform early intervention and avoid fetal death. It is received, for anatomopathological study, a fetus of undetermined sex product of the first pregnancy of a 19 year-old mother without previous prenatal controls, with the presence of a large cystic mass that extends from the face to the neck. The histological study confirms the diagnosis of cystic hygroma. As there was no karyotype analysis, it was not possible to establish the preexistence of any genetic abnormality. Also known as cystic lymphangioma, is a benign vascular tumor whose antenatal diagnosis by ultrasonography is essential in the evolution and prognosis of the disease. Unfortunately in our case, the lack of prenatal controls and the absence of ultrasonographic studies that would allow knowing the characteristics of this lymphangioma, could significantly impact in the fatal outcome.
Key words: Lymphangioma; Prenatal diagnosis; Fetal nuchal translucency
Received: 04/14/2020
Revised version received: 09/19/2020
Accepted: 10/22/2020
INTRODUCCIÓN
El higroma quístico es una malformación del sistema linfático que se origina desde el desarrollo embrionario (Aymelek et al., 2019), pudiendo ser de carácter transitoria o persistente (Özcan et al., 2019). La ubicación más frecuente es a nivel cervical y se puede asociar a síndromes genéticos y anormalidades cromosómicas (Schreurs et al., 2018). El diagnóstico del higroma quístico se hace a través de la ultrasonografía midiendo la translucencia nucal fetal en el primer trimestre del embarazo (Cicatiello et al., 2019). Como exámenes complementarios, tenemos el análisis de cariotipo y el microarray cromosómico para confirmar la presencia o ausencia de aneuploidías (Schreurs et al., 2018; Cicatiello et al., 2019). Generalmente este tipo de malformación tiene pobre pronóstico, particularmente si se asocia a otras condiciones como la hidropesía fetal (Özcan et al., 2019). El objetivo de la presentación de este caso es resaltar la importancia del diagnóstico antenatal del higroma quístico, con el fin de realizar una intervención precoz y evitar la muerte fetal.
MATERIALES Y MÉTODOS
Declaración ética, consentimiento y permisos
Este estudio se realizó bajo los lineamientos de la Declaración de Helsinki, así como la resolución N° 8430 de 1993 y N° 2378 de 2008 del Ministerio de Salud y Protección Social de Colombia, los cuales velan por los intereses de los sujetos estudiados. Se brindó la información necesaria a familiares, en este caso a los padres por ser los representantes legales, se aclararon dudas y posteriormente se firmó el consentimiento informado previo al inicio del estudio.
Metodología
Se recibe al producto del primer embarazo de una mujer de 19 años de edad, remitido a la Facultad de Medicina de la Universidad de La Sabana, para estudios anatomopatólogicos, genéticos e imagenológicos complementarios. Posteriormente, se realiza la búsqueda de literatura en bases de datos como PubMed, Clinicalkey, Science Direct y OMIM para presentar el caso clínico reportado y la información disponible actualizada.
Reporte de caso
Se recibe feto de sexo indeterminado producto de primer embarazo de madre de 19 años de edad, sin previos controles prenatales, quien al examen macroscópico presentaba una longitud cráneo-plantar de 21 centímetros y 7 centímetros de perímetro cefálico, con presencia de una gran masa quística de 7 cm de largo por 4 cm de ancho, que se extiende desde la región frontal hasta la nuca (Figura 1). Al corte impresiona una masa quística, unilocular, de superficie lisa y pared menor de 0,1 cm ocupada por contenido acuoso, sin conexión a meninges ni encéfalo, de aspecto normal y con severa autolisis (Figura 2). Los huesos cráneo-faciales son de características usuales (Figura 3A). En cara, los ojos están presentes y normalmente localizados, la boca es normal, mientras que la piel tanto de la nariz como de la cara están severamente edematosas. Los miembros superiores e inferiores están presentes y poseen un marcado edema. En la descripción interna de los órganos al corte, los pulmones se encuentran presentes y atelectásicos. El corazón es pequeño, en el hígado hay autolisis y los riñones están presentes pero disminuidos en tamaño (Figura 3B). A su vez, la placenta presenta focos de consistencia firmes y en el cordón umbilical se observan dos vasos sanguíneos (Figura 3C).
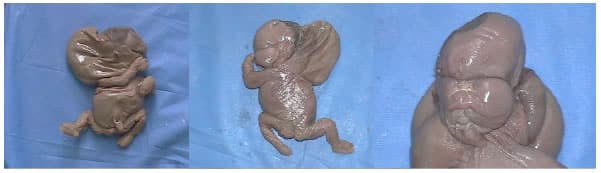
Figura 1. Feto de sexo indeterminado con presencia de una gran masa quística que abarca rostro, cuero cabelludo y nuca.
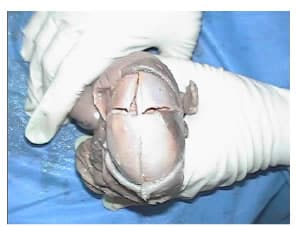
Figura 2. Al corte se observa una gran cavidad quística de aspecto normal y contenido acuoso, sin conexión a meninges ni encéfalo. Las estructuras óseas son de aspecto usual.
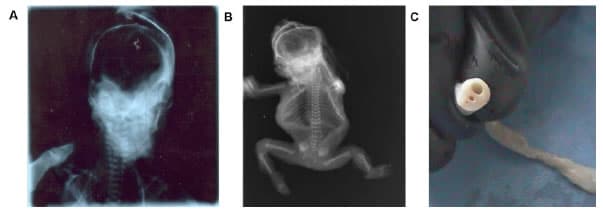
Figura 3. A) Los huesos de la cara son de características usuales; B) Se observa atelectasia pulmonar y disminución del tamaño del corazón y ambos riñones, el resto de órganos sin anomalías; C) En el cordón umbilical se observan dos vasos sanguíneos.
RESULTADOS
Los cortes histológicos con Hematoxilina Eosina mostraron una dilatación de los conductos linfáticos asociados a espacios vasculares grandes e irregulares revestidos por células epiteliales aplanadas con un estroma fibroblástico con linfocitos en su interior, hallazgos que corresponden a un tumor vascular benigno de tipo linfangioma quístico (Figura 4). Esta malformación corresponde a una anomalía de los vasos linfáticos yugulares que impide el correcto drenaje de la linfa (Noia et al., 2019). Un fallo en el canal comunicante o su bloqueo, permite la formación de quistes de retención en región cervical (Schreurs et al., 2018). Asimismo, se asocia a anomalías cromosómicas tales como: Síndrome de Turner, Síndrome de Klinefelter y trisomías 13, 18 y 21 (Özcan et al., 2019). Lamentablemente en este caso, la madre sufre la pérdida gestacional antes de la realización del análisis de cariotipo, además durante el examen postmortem, se tomaron muestras en sangre periférica y bazo buscando obtener células viables pero fue imposible puesto que la toma de muestra para cariotipo se realizó 48 horas posteriores al aborto. Por lo anterior, no se pudo establecer una asociación directa entre el higroma quístico y la presencia de alguna alteración cromosómica concomitante que contribuyera al desenlace final.
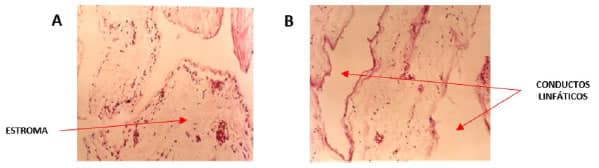
Figura 4. A) Estroma fibroblástico con linfocitos en su interior; B) Dilatación de los conductos linfáticos (H&E x 100)
DISCUSIÓN
El higroma quístico, también conocido como linfangioma quístico, es una malformación vascular/ linfática congénita caracterizada por la dilatación de los conductos y los sacos linfáticos debido a un fallo en la conexión entre el sistema linfático y venoso (Schreurs et al., 2018; Noia et al., 2019). Esta malformación se encuentra frecuentemente ubicada en cuello/ nuca (75%), axilas (20%), retroperitoneo (5%), extremidades (2%) y mediastino (1%) (Chen y Zheng, 2019; Chen et al., 2017). Los higromas quísticos pueden clasificarse según el tamaño en microquísticos (<2 cm), macroquísticos (>2 cm) y mixtos (masa compuesta de múltiples quistes separados por septos) (Munteanu et al., 2016). A su vez, también puede clasificarse en septado y no septado. La incidencia del linfangioma quístico se estima en 1/1.000-6.000 nacidos vivos y 1/750 abortos espontáneos (Yakıştıran et al., 2019). En nuestro caso, se trató de un higroma macroquístico septado en nuca, que por sus características histopatológicas, prometía un final desalentador. El higroma quístico en nuca se ha asociado desde un 50% a un 80% a aneuploidías cromosómicas (Yakıştıran et al., 2019). Entre las aneuploidías más comúnmente observadas tenemos el Síndrome de Turner (60%), el Síndrome de Down, el Síndrome de Klinefelter y las trisomías 18 y 13 (Aymelek et al., 2019; Kadam et al., 2017). En un análisis realizado a 116 fetos con Síndrome de Turner se observó que las anomalías estructurales encontradas fueron, en orden de frecuencia, el higroma quístico (59,5%), la hidropesía fetal (19%), anomalías cardíacas congénitas (7,8%), defecto pulmonar (3,5%), defecto renal (2,6%) y anomalías en el sistema nervioso central (1,7%) (Chen et al., 2018). Del mismo modo, este tumor puede encontrarse en el 22-32% de los fetos con cariotipo normal (Özcan et al., 2019). Sin embargo, en el presente estudio, no fue posible la toma de cariotipo por lo que no se pudo establecer la preexistencia de alguna anomalía genética. El patrón de oro para el diagnóstico antenatal del linfangioma quístico en nuca es la ultrasonografía, procedimiento no invasivo y costo-efectivo (Munteanu et al., 2016). Al final de la quinta semana de gestación, inicia el desarrollo del sistema linfático en el feto (Schreurs et al., 2018; Munteanu et al., 2016). Para la octava semana del embarazo, ya se encuentran desarrollados los primeros seis sacos linfáticos e inicia la comunicación entre los conductos linfáticos yugulares izquierdos y derechos (Aymelek et al., 2019). En el ultrasonido, la imagen del linfangioma quístico puede verse como un área de sonolucencia del tejido blando que consiste en una cavidad simétrica que puede o no estar separada por uno o varios septos (Chen et al., 2017). De esta premisa parte la realización del examen de translucencia nucal fetal para el diagnóstico ultrasonográfico del higroma o linfangioma quístico, el cual cobra vital importancia en el momento de hacer una intervención precoz en estos pacientes y evitar la muerte fetal. Sin embargo, en el caso anteriormente descrito, la falta de controles prenatales no permitió la realización de ningún examen de ultrasonido por lo que no se pudo realizar el diagnóstico antenatal de dicha condición. La medición de la translucencia nucal (TN) se ha convertido en una herramienta útil en el tamizaje de aneuploidías en el primer trimestre de gestación. De acuerdo con la Fundación de Medicina Fetal, la edad gestacional óptima para medir la TN es desde la semana 11 a la semana 13,6 del embarazo (Scholl y Chasen, 2016). Una medida superior al percentil 99 (>3,5 mm) se asocia a un riesgo aumentado de padecer más de 50 condiciones, entre ellas, las anomalías cromosómicas, las malformaciones fetales, el daño cardíaco, ciertos síndromes genéticos y hasta la muerte fetal (Cicatiello et al., 2019). Cuando el higroma quístico es diagnosticado, el feto debe someterse a procedimientos más invasivos como el análisis de cariotipo (Yakıştıran et al., 2019). En los casos donde haya un aumento de la TN con un cariotipo normal, se recomienda la realización del microarray cromosómico o cariotipo molecular (Schreurs et al., 2018). Dicha técnica nos permite identificar deleciones o duplicaciones cromosómicas no diagnosticadas previamente. En un meta-análisis reciente practicado en fetos con aumento de la TN, el microarray cromosómico detectó un 4% de variaciones en el número de copias que no fueron observadas en el cariotipo convencional (Cicatiello et al., 2019). Adicionalmente, existe una relación entre el tipo de aneuploidía y la edad gestacional en la que se diagnostica por primera vez el linfangioma quístico de nuca. Los higromas diagnosticados durante el primer trimestre de embarazo tienden a asociarse a las trisomías 21, 18 y 13 (Gezdirici et al., 2017). Mientras que, en el segundo trimestre de embarazo, los higromas quísticos no septados se relacionan al Síndrome de Down, y los higromas quísticos septados al Síndrome de Turner (Orgul et al., 2017). Como la gran mayoría de los higromas quísticos son diagnosticados en el primer trimestre de embarazo, es de suma importancia realizar un adecuado diagnóstico de los síndromes frecuentemente asociados. La prueba de ADN de células fetales libres en suero materno es un examen no invasivo con una excelente sensibilidad y especificidad en el diagnóstico de las trisomías 21, 18 y 13 (Cicatiello et al., 2019; Reimers et al., 2018). En un análisis reciente, se encontró que esta prueba tiene una tasa de detección para la trisomía 21 del 99% con una tasa de falsos positivos del 0,1%. Sin embargo, la prueba de ADN de células fetales libres es costosa por lo que aún no puede ser considerada como parte del tamizaje rutinario de aneuploidías (Vičić et al., 2017). En cuanto al pronóstico, en términos generales, los higromas quísticos diagnosticados en fases tempranas del embarazo, tienen peor pronóstico que aquellos diagnosticados en el tercer trimestre de gestación (Schreurs et al., 2018). Otros factores que empeoran el pronóstico en pacientes con higroma quístico son: la presencia de anomalías cromosómicas, la hidropesía fetal, una translucencia nucal mayor a 6 mm, los higromas quísticos septados y la asociación con otra malformación mayor (Chen et al., 2017). La combinación de linfangioma quístico e hidropesía fetal resulta en muerte fetal en un 96,5% de los casos (Özcan et al., 2019). A pesar de lo anterior, se ha descripto que el 42 % de los higromas quísticos que alcanzan el término del embarazo desaparecen al nacimiento (Kadam et al., 2017). También se ha descripto la resolución espontánea del higroma antes de la semana 20 de gestación, lo que es considerado factor de buen pronóstico. Sin embargo, en estos casos, se recomienda continuar seguimiento estricto con ultrasonografía y cariotipo mensual (Özcan et al., 2019). Fetos con aumento de la translucencia nucal y cariotipo normal, sin otra anomalía congénita, tienen una tasa de mortalidad perinatal del 3,3% al 11,8 % (Noia et al., 2019). Pero, en caso de presentar un cariotipo anormal, la terminación del embarazo debe tomarse en consideración dado al pobre pronóstico (Munteanu et al., 2016). En cuanto al manejo intrauterino, la escleroterapia debe considerarse en casos donde exista el diagnóstico de higroma quístico en ausencia de hidropesía fetal y anomalías cromosómicas y/o estructurales, o cuando se trate de un higroma macroquístico bajo las mismas condiciones (Waner, 2018). En nuestro caso, y suponiendo que el cariotipo era normal por tratarse de un higroma macroquístico, existía la posibilidad del manejo con agentes esclerosantes. A su vez, el manejo quirúrgico debe considerarse en los casos con obstrucción de la vía aérea, después de la escleroterapia no exitosa y en pacientes con enfermedad microquística (García et al., 2018). Cuando el diagnóstico de higroma quístico se hace en el tercer trimestre de gestación y/o en embarazos a término, no existe un consenso sobre la modalidad de parto. Sin embargo, algunos especialistas prefieren el parto vaginal sobre la cesárea (Munteanu et al., 2016). Debemos tener en cuenta que un gran número de higromas quísticos desaparecen al momento del nacimiento, mientras que otros persisten y deben ser manejados quirúrgicamente a futuro (Waner, 2018).
CONCLUSIÓN
El linfangioma quístico es una malformación congénita rara de pobre pronóstico; traemos a colación este caso para resaltar la importancia del diagnóstico prenatal temprano de las patologías congénitas, por lo que resulta fundamental la realización de los controles prenatales en todas las gestantes con el fin de identificar de manera oportuna alguna malformación que pudiese acarrear consigo desenlaces no favorables. La medición ultrasonográfica de la translucencia nucal fetal, es de gran utilidad en el diagnóstico temprano del higroma quístico. En el caso expuesto, al tratarse de una madre adolescente con nulos controles prenatales, fue imposible anticipar el diagnóstico de dicha malformación, lo que no permitió realizar ningún tipo de intervención y, desafortunadamente, culminó con la pérdida gestacional.
BIBLIOGRAFÍA
Aymelek H.S., Oğur G., Tosun M. (2019) Genetic Burden and Outcome of Cystic Hygromas Detected Antenatally: Results of 93 Pregnancies from a Single Center in the Northern Region of Turkey. J. Med. Ultrasound. 10; 27 (4): 181-186. PMID: 31867191.
Chen C.P., Chang S.Y., Lau H.S. (2018) First-trimester cystic hygroma and omphalocele in a fetus with Turner syndrome. Taiwan J. Obstet. Gynecol. 57 (5): 763-764. PMID: 30342669.
Chen Y.N., Chen C.P., Lin C.J. (2017) Prenatal Ultrasound Evaluation and Outcome of Pregnancy with Fetal Cystic Hygromas and Lymphangiomas. J. Med. Ultrasound. 25 (1): 12-15. PMID: 30065449.
Chen H.Y., Zheng J.Q. (2019) A case report of Turner syndrome associated with fetal nuchal cystic hygroma and bilateral syndactyly of the hands and feet. Ital. J. Pediatr. 18; 45 (1): 85. PMID: 31319890.
Cicatiello R., Pignataro P., Izzo A. (2019) Chromosomal Microarray Analysis versus Karyotyping in Fetuses with Increased Nuchal Translucency. Med. Sci. 7 (3). PMID: 30818867.
García S., Padilla A., Martínez I. (2018) Diagnóstico y pronóstico prenatal de linfangiomas fetales. Reporte de dos casos. Ginecol. Obstet. Mex. 86 (12): 831-840. DOI: https://doi.org/10.24245/gom.v86i12.2112.
Gezdirici A., Ekiz A., Güleç E.Y. (2017) How necessary is to analyze PTPN11 gene in fetuses with first trimester cystic hygroma and normal karyotype? J. Matern. Fetal Neonatal Med. 30 (8): 938-941. PMID: 27193571.
Kadam R.M., Kumar A.N., Prasad V. (2017) Giant Cervico-Thoracic Cystic Hygroma in a Preterm: A Case Report. J. Neonatal. Surg. 10; 6 (3): 66. PMID: 28920026.
Munteanu O., Cîrstoiu M.M., Filipoiu F.M. (2016) Morphological and ultrasonographic study of fetuses with cervical hygroma. A cases series. Rom. J. Morphol. Embryol. 57 (4): 1421-1427. PMID: 28174814.
Noia G., Maltese P.E., Zampino G. (2019) Cystic Hygroma: A Preliminary Genetic Study and a Short Review from the Literature. Lymphat Res. Biol. 17 (1): 30-39. PMID: 30475086.
Orgul G., Ozyuncu O., Oktem A. (2017) Management and outcomes of cystic hygromas: experience of a tertiary center. J. Ultrasound. 20 (2): 127-131. PMID: 28593002
Özcan H.Ç., Uğur M.G., Balat Ö. (2019) Analysis of cystic hygroma diagnosed in the prenatal period: 5-years’ experience at a tertiary hospital in Southeastern Turkey. J. Matern. Fetal Neonatal Med. 32 (11): 1800-1805. PMID: 29241391.
Reimers R.M., Mason Suares H., Little S.E. (2018) When ultrasound anomalies are present: An estimation of the frequency of chromosome abnormalities not detected by cell-free DNA aneuploidy screens. Prenat. Diagn 38. (4): 250-257. PMID: 29436713.
Scholl J., Chasen S.T. (2016) First trimester cystic hygroma: does early detection matter? Prenat. Diagn. 36 (5): 432-6. PMID: 26934494.
Schreurs L., Lannoo L., De Catte L. (2018) First trimester cystic hygroma colli: retrospective analysis in a tertiary center. Eur. J. Obstet. Gynecol. Reprod. Biol. 231: 60-64. PMID: 30321790.
Vičić A., Hafner T., Bekavac Vlatković I. (2017) Prenatal diagnosis of Down syndrome: A 13-year retrospective study. Taiwan J. Obstet. Gynecol. 56 (6): 731-735. PMID: 29241910.
Waner M. (2018) Multidisciplinary Approach to the Management of Lymphatic Malformations of the Head and Neck. Otolaryngol. Clin. North Am. 51 (1): 159-172. PMID: 29217060.
Yakıştıran B., Altınboğa O., Canpolat E. (2019) Analysis of cystic hygroma diagnosed in the first trimester: single-center experience. J. Turk. Ger. Gynecol. Assoc. PMID: 31298510.



