Vol. XXXII Issue 2
Article 2
DOI:
10.35407/bag.2021.32.02.02
RESEARCH
Mejoramiento de arveja (Pisum sativum L): avances del
programa de mejoramiento genético de la Universidad Nacional de Rosario
Pea (Pisum sativum
L.) breeding: advances of the breeding program at Universidad Nacional de
Rosario
Gatti
I.1
Cazzola
F.2
Bermejo
C.J.2
Guindón
M.F.2
Espósito
M.A.2,3
Cointry
E.L.2 *
1 CIUNR, Consejo de
Investigadores de la Universidad Nacional de Rosario, Rosario, Argentina;
2 Instituto de
Investigaciones en Ciencias Agrarias de Rosario, Consejo Nacional de
Investigaciones Científicas y Técnicas (IICAR-CONICET), Facultad de Ciencias
Agrarias, Universidad Nacional de Rosario (UNR), Zavalla, Argentina;
3 Instituto Nacional
de Tecnología Agropecuaria, EEA INTA Oliveros, Ruta Nacional 11 km 353, Oliveros,
Santa Fe.
* Corresponding author: Cointry, E.L. ecointry@unr.edu.ar
ORCID 0000-0001-5906-7291
General Editor: Elsa Camadro
RESUMEN
En
2005 se inició un programa de mejoramiento de arveja para aumentar la
producción en cantidad y calidad en la Facultad de Ciencias Agrarias (FCA),
Universidad Nacional de Rosario (UNR). Los primeros pasos fueron reunir una
colección activa de germoplasma de todo el mundo y analizar la variabilidad
genética a través de rasgos morfo-agronómicos y moleculares. En 2014, el
Instituto Nacional de Tecnología Agropecuaria (INTA) y la FCAUNR unieron
esfuerzos para promover el desarrollo local de genotipos de arveja adaptados a
la región. Este programa, utilizando metodologías convencionales, ha obtenido
hasta el momento una nueva variedad comercial (Primogénita FCA-INTA) de color
de cotiledón verde, semi-áfila, con alta adaptación a las condiciones
agroecológicas locales y alto potencial de rendimiento. El mejoramiento
genético, sin embargo, es un proceso lento. El desarrollo de nuevas variedades
requiere una década o más utilizando metodologías tradicionales, por lo que se
propusieron diferentes alternativas para la reducción de este período. Los
haploides duplicados y el cultivo in vitro han sido algunas de las metodologías
desarrolladas, sin embargo, en legumbres no se han podido implementar de manera
eficiente en los programas de mejoramiento. En este contexto, Speed Breeding
surge como una tecnología que permite incrementar la eficiencia de los
programas, reduciendo los costos y el trabajo requerido.
Palabras clave: Arveja, Metodologías convencionales, Speed Breeding, Haploides
duplicados.
ABSTRACT
A pea breeding program to
increase production in quantity and quality was started in 2005 in the College
of Agrarian Sciences (FCA), National University of Rosario (UNR). The first
steps were to gather an active collection of germplasm from around the world
and to analyze genetic variability through morpho-agronomic and molecular
traits in order to set objectives. In 2014, the National Institute of
Agropecuarian Technology (INTA) and the FCAUNR, joined forces to unite
inter-institutional efforts for promoting the local development of pea
genotypes adapted to the region. This program, using conventional
methodologies, has so far obtained a new commercial line (Primogénita FCA-INTA)
of green cotyledons, semileafless, with high adaptation to local agro ecological
conditions and high yield potential. Breeding, nevertheless, is a slow process.
Developing new pea varieties usually takes a decade or more when using
traditional methodologies; thus, different alternatives were proposed for the
reduction of this period. Doubled haploids and in vitro culture have been some
of the methodologies developed; in pulses, however, they have not been
efficiently implemented in breeding programs. In this context, Speed Breeding
emerges as a technology that allows increasing the efficiency of the programs,
while reducing costs and the required labor.
Key words: Peas,
Conventional methodologies, Speed
Breeding, Doubled haploids.
Received: 10/09/2020
Accepted: 10/24/2020
INTRODUCCIÓN
Sistemática y origen geográfico
La
arveja (Pisum sativum L.) es una especie diploide 2n=14, anual y autógama
perteneciente a la familia de las leguminosas (subfamilia: Faboideae, tribu:
Fabeae). Presenta una importante ventaja ecológica al contribuir al desarrollo
de una agricultura de bajos insumos debido a la fijación de nitrógeno
atmosférico, y minimiza la necesidad de insumos externos (Smýkal
et al., 2012;
Guindon et al., 2018). Esta leguminosa es considerada la fuente más económica
de proteínas (23-33%) tanto para la nutrición humana como animal (Cousin
et al., 1985;
Gupta
et al., 2015).
A su vez es uno de los cultivos más antiguos domesticados en el mundo (Zohary
y Hopf, 2000).
El género Pisum incluye especies silvestres como P. fulvum originarias del
Medio Oriente (Smýkal et al.,2017) y especies cultivadas como P. abyssinicum
provenientes de Yemen y Etiopía, y que probablemente, fue domesticada
independientemente de P. sativum, y un conjunto de formas silvestres (P.
sativum subsp. elatius) y formas cultivadas que comprenden la especie P.
sativum en un sentido amplio (Trněný et al.,
2018)
que son nativas de la región mediterránea de Europa y del centro y noroeste de
Asia (Smýkal et al., 2017). Dos acervos genéticos fueron encontrados en este
género. El acervo genético primario incluye P. sativum con sus diferentes
subespecies, variedades botánicas y comerciales, mientras que el acervo
genético secundario está compuesto por P. fulvum y P. abyssinicum (Coyne
et al., 2020).
Nuestro equipo de trabajo adoptó el sistema taxonómico de Pisum esbozado por
Maxted y Ambrose (2001) y Bogdanova et al. (2020).
Según
este sistema generalizado, el género abarca tres especies, a saber, P. sativum
L., subsp. sativum (incluye var. sativum y var. arvense); subsp. elatius
(Bieb.) Aschers. & Graebn (incluye var. elatius, var. brevipedunculatum y
var. pumilio), P. fulvum Sibth. & Sm. y P. abyssinicum A. Br.
Importancia económica
Es
la segunda leguminosa más cultivada a nivel mundial con una producción de
16.205 x 106tn en 2017 (FAO, 2019). La demanda de arveja es alta y sostenida
dado el alto consumo en países asiáticos como India, China y Bangladesh, que
son los principales consumidores del mundo. A nivel mundial, el mayor
exportador es Canadá, seguido de Rusia y Estados Unidos y, en menor escala,
Francia y Australia. En América del Sur, el principal productor y exportador de
arveja es Argentina (Janzen et al., 2014) estando en el
noveno puesto entre los exportadores mundiales (Calzada y Treboux,
2019).
Producción en Argentina
En
la Argentina el cultivo en secano se realiza en forma extensiva cuando el
objetivo es cosechar grano seco y en forma intensiva para obtener granos o
vainas para consumo en fresco. La arveja para grano seco se cultiva
tradicionalmente en la zona norte de la provincia de Buenos Aires y sudeste de
Santa Fe. Entre ambas provincias suman más del 90% de la superficie sembrada en
el país (Prieto y Vita, 2010). En los últimos
años se ha extendido la propuesta productiva a la zona oeste y centro de Buenos
Aires y Santa Fe, sur de Córdoba y oeste de Entre Ríos (De
Bernardi, 2016).
Del total de arvejas producidas, el 88-90% se destina a grano seco, el 7-8% a
grano verde fresco para enlatado y/o congelado y el resto para chaucha fresca
(SAGPyA, 2010). El cultivo en nuestro país está siendo considerado cada vez más
como una alternativa viable, tanto por su rentabilidad como por sus beneficios
como antecesor de los cultivos de verano. Se han realizado estudios que
demuestran que el cultivo de soja rinde un 25% más cuando el cultivo anterior
fue la arveja, y en el caso del maíz los rendimientos aumentan entre 2.000 y
2.500 kg/ ha (Prieto, 2018). La arveja como antecesora posee dos ventajas
importantes: la primera, que consume menos agua que el trigo (el 60% de lo que
utiliza el cereal) y deja el segundo metro del perfil de suelo con toda el agua
disponible. La otra ventaja es que el balance de nitrógeno que queda luego del
cultivo, en comparación con el trigo, es menos negativo (Prieto, 2018).
Calidad de la arveja
Son
alimentos concentrados con un alto porcentaje de materia seca y proteína,
carbohidratos solubles, bajo contenido en grasas, fibras que varían en torno al
8 % y sustancias minerales (Grusak, 2002). El contenido de
proteína en las semillas varía del 17% al 40%, en contraste con los cereales
(7-13%) e igual al contenido de proteína que se encuentra en la carne (18-25%)
(Pandey
et al., 2016).
En comparación con los cereales, son ricas en lisina y pobres en aminoácidos
azufrados como la metionina y la cisteína. También son ricas en vitamina C y
hay un aumento en el contenido de riboflavina y niacina después de la
germinación (Swaminathan, 1988).
En
nutrición humana, son utilizadas en una amplia variedad de platos y se consumen
como semillas secas enteras o molidas. Se extraen aislados de almidón y
proteínas de alta calidad y se han evaluado las características estructurales y
funcionales de las semillas enteras para mejorar la alimentación (Brummer
et al., 2015).
Debido a que las semillas secas contienen pocos factores antinutricionales,
también se utilizan como fuente de proteínas principalmente en dietas
monogástricas (Dotas et al., 2014), y trabajos
recientes han demostrado el valor de la arveja como reemplazo de la soja en las
raciones para cerdos, aves, pescado y rumiantes (Anthony, 2017). Asimismo, el heno
de arveja se utiliza como forraje en la dieta de los rumiantes (Bastida
García et al., 2011).
Al mismo tiempo, tienen una fuerte presencia en el mercado de alimentos
procesados, con una gran diversidad de productos. La arveja enlatada
rehidratada es uno de los productos con mayor volumen de exportación del sector
de las verduras enlatadas en Argentina (después de las preparaciones de tomate)
y tiene una participación de mercado mundial cercana al 1%, abasteciendo
principalmente a países vecinos. Además, se utilizan en sopas instantáneas,
snacks, productos de cereales congelados, hamburguesas y empanadas, barritas
energéticas, harinas ricas en proteínas y fibra (20% y 17% respectivamente) y
almidones, fibras y aislados o concentrados de proteínas que se utilizan para
agregar en productos cárnicos cocidos, frescos y embutidos. La posibilidad de
alimentar ganado vacuno, lechero, porcino y aves de corral con granos de arveja
permite diversificar la producción e incorporar la ganancia en origen
especialmente en las pequeñas explotaciones.
Planes de Mejoramiento
Los
esfuerzos de mejoramiento para desarrollar nuevos cultivares han dado lugar en
gran medida a la división del germoplasma de arveja en diferentes grupos,
diferenciados principalmente por el uso final y el tipo de mercado (Zong et
al., 2009; Burstin et al., 2015). En resumen, según
la morfología del grano y el momento de su cosecha, las arvejas se pueden
clasificar en:
•
Dried peas (lisas o field pea), son las arvejas recolectados en plena madurez,
en parte para consumo humano, pero principalmente para alimentación animal.
•
Green peas (arrugadas o garden pea), las vainas se cosechan en la etapa R4
(vaina llena) para consumo humano como hortalizas frescas y los granos inmaduros
para consumo directo, enlatado o congelado.
Los
objetivos de mejoramiento dependen del tipo de arveja a producir. Nuestro grupo
de trabajo se ha enfocado principalmente en el mejoramiento de arvejas secas
estando, sin embargo, iniciando un programa para Green peas. Para el caso de
las arvejas secas manejamos tanto germoplasma correspondiente a arvejas con
color de cotiledón amarillo como verde siendo, este último, el de cultivo más
común en nuestro país.
En
este tipo de materiales se busca la obtención de variedades semi-áfilas, que
por tener reemplazado los folíolos por zarcillos, permiten una mayor incidencia
de la radiación solar en las plantas permitiendo que maduren correctamente las
vainas inferiores. Por otro lado, los zarcillos de las diferentes plantas en el
cultivo se unen evitando así el vuelco de las mismas en la madurez que puede
ser provocado por el peso de las vainas. Por el contrario, las plantas foliosas
tienden a ser más susceptibles a las enfermedades foliares, pero presentan un
mayor rendimiento. En nuestro país, las variedades de mayor difusión son Facón
que es de grano verde liso, foliosa, y semi-rastrera y Viper que presenta un
grano verde liso, es semi-áfila y erecta; pero si se desea afianzar nuestro
protagonismo en el mundo será necesario ofrecer otros tipos varietales, tales
como arvejas de cotiledones amarillos, variedades con resistencia al blanqueado
de la semilla, mejor estructura de planta (semiáfilas) y comportamiento
sanitario superador, de tal manera de ir satisfaciendo las necesidades de otros
mercados no tradicionales. Se busca, asimismo, reducir los días a floración
como la altura de la planta con el fin de obtener materiales precoces (con
fechas a floración cercanas a 70 días) que permitan liberar más tempranamente
el lote, a fin de poder realizar cultivos de segunda y plantas de 60-65 cm, ya
que plantas de mayor altura son más susceptibles al vuelco, mientras que, las
de menor altura resultan ser pobres competidoras con las malezas. Por otro
lado, también se busca, como en todos los cultivos, un incremento de todas las
variables productivas, estabilidad de la producción y la resistencia a factores
bióticos y abióticos (Guindon et al., 2018).
Nuestro
programa de mejora comenzó con una etapa de pre-breeding mediante la
construcción de una colección activa de arveja con la importación de materiales
de los bancos de germoplasma del USDA (EEUU) y del John Innes Pisum Collection
(UK) y materiales derivados de nuestro programa de mejora, contando actualmente
con más de 300 entradas del género Pisum (ssp. fulvum, abyssinicum y sativum)
como así también de las subespecies asiaticum, elatius, jomardi, sativum y
transcaucasicum y diferentes cultivares dentro de cada subespecie, con
materiales de grano liso (arveja seca) y de tipo rugoso (arveja hortícola para
consumo fresco). Dicha colección se multiplica periódicamente y es evaluada a
través de diferentes tipos de marcadores: morfológicos, agronómicos,
ecogeográficos, moleculares y bioquímicos. Con el objetivo de contribuir a una
mejor utilización de las accesiones en los programas de mejoramiento, Espósito
et al. (2019)
construyeron una colección núcleo (core collection). Para ello se evaluó la
colección de germoplasma mediante rasgos morfológicos, caracterización
molecular a través de marcadores SSR y SRAP y validando la misma, demostrando
que la estrategia logarítmica con datos sobre valores genotípicos fue la
estrategia superior.
Mediante
siglos de selección empírica y mejoramiento se han desarrollado miles de
variedades que se mantienen en colecciones de germoplasma en todo el mundo
(Smýkal et al., 2011). En Argentina, a pesar de haber inscriptas en el Registro
Nacional de Cultivares más de 70 variedades correspondientes a diferentes
empresas semilleras internacionales, solo se cultivan mayoritariamente, como se
dijo con anterioridad, dos variedades. Esta situación hace necesaria la
creación de nuevas variedades de origen nacional que se encuentren adaptadas a
nuestras condiciones de cultivo.
Métodos de mejoramiento
El
sistema más comúnmente utilizado para desarrollar cultivares de línea pura
consiste en hibridar artificialmente dos o más líneas parentales seleccionadas,
permitiendo que la primera generación filial (F1) se autofecunde para obtener
semilla F2 y continuar avanzando hacia la homocigosis práctica, aproximadamente
en las generaciones F5 o F6, donde se inicia la evaluación de los productos
obtenidos para determinar su potencial comercial. Durante el avance
generacional se puede aplicar selección para reducir gradualmente la cantidad
de productos obtenidos (método Genealógico o Pedigree) o llegar al final del
proceso conservando la mayor variabilidad genética posible y, luego de la
multiplicación de semillas, realizar la selección por el método de descendiente
de semilla única o SSD (Single Seed Descent). En cualquier caso, los productos
finales son líneas puras. Estos son los métodos que se utilizan en la mayor
parte del mundo y en nuestro programa de leguminosas de grano. Nuestro programa
convencional de mejora Se comenzó un trabajo de hibridación entre materiales de
diferentes orígenes, pero con características sobresaliente, a fin de lograr la
creación de poblaciones F2 que pudiesen someterse a procesos de selección. El
INTA inició, a través de sus proyectos nacionales INTA PNHFA1123 (2006-09) y
PNHFA1231 (2009- 12) un programa de mejora de legumbres en general, denominado
“Desarrollo de bases tecnológicas para el aumento de la competitividad con
sostenibilidad de las Legumbres en Argentina”, estableciéndose un convenio
específico entre la Facultad de Ciencias Agrarias de la UNR y la EEA INTA
Oliveros con el objeto de obtener nuevas variedades de arveja y lenteja.
Como
resultado de este esfuerzo conjunto nos encontramos en las etapas de
licenciamiento de la primera variedad nacional y de origen estatal Primogénita
FCA-INTA. Esta variedad surge del cruzamiento de la variedad Viper semi-áfila
con color de cotiledón verde por la variedad DDR 14 creada por The Indian
Council of Agriculture Research, foliosa, con color de cotiledón amarillo y
vainas y grano grande. La variedad DDR 14 fue utilizada como progenitor
masculino debido a los marcadores fenotípico dominantes presentes que
facilitaron la seguridad de la obtención de semillas provenientes del cruzamiento.
Este fue una de los cientos de cruzamientos efectuados en el año 2009, en la
Sección Horticultura de la Facultad de Ciencias Agrarias, con materiales de la
colección activa.
En
el año 2010 se sembraron las semillas F1 y se cosecharon las semillas F2. Desde
el año 2012 al 2015 se realizó un esquema SSD. Una vez alcanzada la homocigosis
práctica se sembraron todas las semillas de las diferentes líneas obtenidas que
fueron multiplicadas y sometidas a ensayos preliminares de rendimiento teniendo
en cuenta también el porte de la planta. De esta selección surge la variedad
PRIMOGÉNITA FCA INTA (Figura 1). En 2017 se consideró que la
variedad estaba estabilizada y a partir de ese año se comenzaron las
multiplicaciones en la EEA INTA Oliveros y se realizaron ensayos comparativos
de rendimiento en diferentes localidades. Esta nueva variedad se caracteriza
por presentar un rendimiento superior a las variedades de uso corriente, con
seis granos en promedio por vaina de un color verde, buen porte a cosecha, y
resistencia parcial a oídio. En ensayos de cuatro años (2016 al 2019) mostró un
rendimiento de 2360,58 kg/ha frente a 1874,94 kg/ha de la variedad Viper.

Figura 1. Primogénita FCA-INTA. a: Planta en
floración, b: etapa de formación de vainas.
La
obtención de esta variedad requirió 10 años de trabajo y la evaluación de
cientos de cruzas. En general, nos encontramos con dos pasos clave en la mejora
de esta especie y de otras leguminosas de grano:(a) la elección de progenitores
a ser utilizados en los bloques de cruzamientos para la creación de
variabilidad genética y b) la necesidad de incrementar la ganancia genética o
eficiencia del proceso. El desarrollo exitoso de nuevas variedades depende
fundamentalmente de la selección de las líneas a hibridar a fin de lograr
generaciones segregantes que muestren individuos superiores capaces de
convertirse en nuevas variedades de cultivo. En los programas de mejoramiento
genético de cultivos autógamos, se efectúa una gran cantidad de hibridaciones
cada año para posteriormente disponer de un gran número de líneas recombinantes
en las generaciones posteriores, a fin de poder efectuar el proceso selectivo.
No todas ellas podrán convertirse en variedades superiores, sino que sólo un
número muy bajo de las mismas podrán cumplir con los requisitos del programa.
Sería por lo tanto muy conveniente determinar qué materiales deben ser
hibridados a fin de obtener variedades superiores.
Materiales a hibridar
La
aparición de variantes transgresivas que puedan ser seleccionadas es sumamente
importante ya que está conectada con la posibilidad de obtención de variedades
superiores. Si bien los individuos transgresivos observados en la generación F2
pueden ser altamente heterocigóticos podrá fijarse o mantenerse la heterosis si
el vigor resulta de la acumulación de alelos dominantes (Jones,
1957;
Sarawat
et al., 1994).
Guindon et al. (2018) hallaron segregantes transgresivos favorables para
diferentes caracteres cuantitativos y Cazzola et al. (2020) evaluaron la
frecuencia de segregantes transgresivos en dos poblaciones F2 y sus respectivas
familias F2:3, obteniendo un 45% para todas las características estudiadas en
las generaciones F2 y, posteriormente, un 42% de estos segregantes
transgresivos se manifestaron en la generación F2:3, lo que sugiere que podrían
producirse líneas superiores. La predicción de segregantes transgresivos puede
realizarse a partir de diferentes metodologías. Sin embargo, Cattáneo
et al. (2020)
demostraron mediante la utilización de cruzamientos dialélicos de media matriz,
entre 11 variedades de nuestra colección activa correspondientes a germoplasma
de origen diferentes (Europa, Asia, América del Norte y América del Sur), que
la evaluación de la aptitud combinatoria general de los parentales resultó ser
eficiente como metodología para estimar a priori cruzas heteróticas y
segregantes transgresivos. Aceleración de generaciones Con respecto al segundo
punto, el fitomejoramiento es un proceso lento. El desarrollo de nuevas
variedades requiere una década o más, utilizando metodologías tradicionales. Es
una operación logística a gran escala que involucra de miles a cientos de miles
de plantas en la etapa inicial de fijación de la línea, pero el número se
reduce en gran medida a un pequeño número seleccionado de líneas de
mejoramiento avanzadas al final del proceso de mejoramiento (Lenaerts
et al., 2019).
En la ecuación del mejorador, el tiempo de cada ciclo de cultivo es el más
fácil de entender, el más barato de manipular y el parámetro más poderoso para
aumentar la ganancia genética (Cobb et al., 2019). Dentro de los
métodos convencionales de mejoramiento, el método SSD (Goulden,
1941;
Saxena
et al., 2019)
nació de la necesidad de acelerar los programas mediante la endogamia rápida de
una población antes de comenzar la selección y evaluación de plantas
individuales, mientras se reduce la pérdida de genotipos durante las
generaciones segregantes. Este método puede realizarse en contra-estación ya
que no se efectúa selección en las primeras etapas. Brummer et al. (2011) y Atlin et al. (2017) sugirieron la
siembra fuera de estación. Sin embargo, en un cultivo como la arveja, Ochatt y
Sangwan (2010) determinaron que sólo se podrían obtener dos generaciones por
año cambiando el hemisferio o tres con el uso de invernadero. Por otro lado, Sita
et al. (2017)
sugirieron que los viveros fuera de estación (siembra primavera-verano) en el
mismo hemisferio no es una alternativa confiable debido a la pérdida
significativa de material segregante por efecto de las altas temperaturas.
Provoca el aborto de flores, vainas y granos. Teniendo en cuenta estos
inconvenientes nuestro grupo de trabajo comenzó a trabajar, a la par de los
métodos estrictamente convencionales, con dos metodologías de aceleración:
·
Cultivo de anteras
· Speed Breeding.
Cultivo de anteras
La
inducción de haploides por cultivo in vitro de células gametofíticas,
particularmente gametofitos masculinos, es de enorme importancia en los
programas de mejoramiento de cultivos (Pratap et al., 2018). La producción de
doble haploides (DH) o haploides duplicados, permite desarrollar genotipos
completamente homocigotos a partir de padres heterocigóticos en una sola
generación y permite fijar los gametos recombinantes directamente como líneas
homocigóticas fértiles (Pratap et al., 2006; Forster et al., 2007). Sin embargo, las
leguminosas han sido descritas como recalcitrantes a este enfoque (Germana
et al., 2011;
Gatti
et al., 2016)
por lo que su implementación no es factible además de ser costosa por el equipo
requerido reduciendo también las posibilidades de recombinación (Liu
et al., 2016).
Sin embargo, Bermejo et al. (2020) estudió la
competencia androgénica de diferentes especies de arveja (tanto silvestres como
cultivadas). Se realizó un estudio comparativo de la respuesta androgénica
entre diferentes taxones del género Pisum, tanto del acervo genético primario
como secundario. Se encontraron diferencias significativas en el porcentaje de
producción de callos y plantas entre las diferentes especies y subespecies. Las
dos formas silvestres, Pisum fulvum Sibth. & Sm. y Pisum sativum subsp.
elatius (Bieb.) Aschers. & Graebn., regeneraron vástagos a partir del
cultivo de anteras con una elevada eficiencia (67% y 38%, respectivamente),
convirtiéndose en fuentes potenciales de competencia androgénica (Figura
2).
Entre los genotipos cultivados de P. sativum, la variedad botánica arvense
regeneró vástagos en un porcentaje del 40% siendo también un buen candidato
para el estudio de la androgénesis. P. fulvum, P. sativum subsp. elatius y P.
sativum ssp. sativum var. arvense se identificaron como altamente sensibles al
cultivo de anteras, útiles para transferir la competencia androgenética a
variedades comerciales.
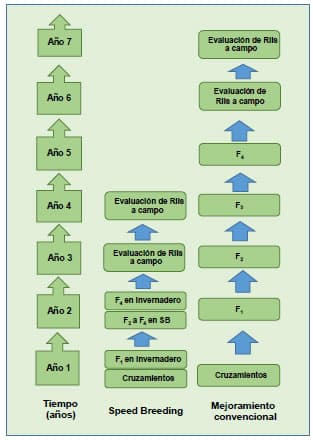
Speed Breeding
El
concepto de Speed Breeding se inspiró en los esfuerzos de la NASA para cultivar
en el espacio, utilizando cámaras cerradas y fotoperíodo extendido. Al
observarse la obtención de plantas adultas de trigo y cebada, más rápidamente
se convirtió en la norma en las actividades de investigación de cereales en la
Universidad de Queensland (UQ), Australia (Hickey et al., 2019). Incluye el
crecimiento de plantas en cámaras o invernaderos. Esta aceleración rápida de
generaciones fue desarrollada en diferentes cultivos con el fin de acortar el
ciclo del mismo y aumentar la eficiencia de los programas de mejora. Se
desarrollaron diferentes protocolos para distintas especies tales como maní (O’Connor
et al., 2013),
arroz (Collard et al., 2017), cebada y trigo (Watson
et al., 2018),
soja (Nagatoshi et al., 2018) y garbanzo (Samineni
et al., 2019).
Cazzola et al.
(2020) desarrollaron un
protocolo para el cultivo de arveja trabajando en cámaras de cría, utilizando
luz artificial con fotoperíodos inductivos (22 hs luz), temperatura y humedad
controladas y cosecha anticipada de granos (24 días post-antesis) (Figura
3).
Se utilizó un sistema hidropónico con el agregado de la antigiberelina
Flurprimidol para reducir el tamaño de las plantas y una metodología SSD que es
la más aconsejada ya que sólo requiere una semilla por planta F2. La ventaja
del sistema radica en el hecho de poderse iniciar en cualquier momento del año
e independizarse de las condiciones bióticas y abióticas, aumentar la
eficiencia de los programas significativamente ya que se reduce el espacio
necesario (266 pl/m2), reduciendo considerablemente los costos y
labores necesarias, pero la gran ventaja es que pueden obtenerse cinco
generaciones por año. En la actualidad se encuentran en evaluación en el Campo
Experimental de la Facultad de Ciencias Agrarias de la UNR 150 nuevas Ril´s
provenientes de hibridaciones dirigidas y obtenidas por el sistema de Speed
Breeding.

Figura 2. a) Botones florales de P. fulvum en el
estado uninucleado; b) formación de callo embriogénico verde; c) callo en
diferentes etapas de embriogénesis somática en el medio de maduración del
embrión; d, e y f) embriones en estado globular (d); corazón (e); cotiledonal
(f); g) plántulas desarrollada en medio de regeneración.

Figura 3. a) Plántulas de arveja en el sistema de
Speed Breeding; b) plantas con flores y vainas.
Estos
últimos avances en los sistemas de cultivos controlados resultan en una gran
oportunidad para incorporarlos a los diferentes programas de mejora.
Esquemáticamente un programa de mejora con SB y un programa convencional se
presentan a continuación:
BIBLIOGRAFÍA
Anthony J.B. (2017) Peas and
beans. In: Atherton J. (Ed.) Crop production science in horticulture (series). CABI,
Oxford shire, pp. 66-93.
Atlin G.N., Cairns J.E., Das B. (2017)
Rapid breeding and varietal replacement are critical to adaptation of cropping
systems in the developing world to climate change. Global Food Secur. 12: 31-37.
Bastida García J.L., González
Ronquillo M., Domínguez Vara I.A., Romero Bernal J., Castelán Ortega O. (2011) Effect
of field pea (Pisum sativum L.) level on intake, digestion, ruminal
fermentation and in vitro gas production in sheep fed maintenance diets. Anim.
Sci. J. 82: 654-662.
Bermejo C., Guindón F., Palacios T.,
Cazzola F., Gatti I., Cointry E.L. (2020) Comparative androgenetic competence
of various species and genotypes within the genus Pisum L. Plant Cell Tiss
Organ Cult. doi.org/10.1007/s11240-020- 01934-y.
Bogdanova V.S., Shatskaya N.V., Mglinets
A.V., Kosterin O.E., Vasiliev G.V. (2020) Discordant evolution of organellar
genomes in peas (Pisum L.) BioRxiv. doi.org/10.1101/2020.05.19.104224.
Brummer F.C., Barber W.T., Collier
S.M., Cox T.S., Johnson R., Murray S.C., Olsen R.C. (2011) Plant breeding for
harmony between agriculture and the environment. Front Ecol. Environ. 375 9: 561-568.
Brummer Y., Kaviani M., Tosh S.M.
(2015) Structural and functional characteristics of dietary fibre in beans,
lentils, peas and chickpeas. Food Res. Intl 67: 117-125.
Burstin J., Salloignon P., Chabert
Martinello M., Magnin Robert J.B., Siol M., Jacquin F., Chauveau A., Pont C., Aubert
G., Truntzer C., Duc G. (2015) Genetic diversity and trait genomic prediction
in a pea diversity panel. BMC Genomics 16: 105.
Calzada J., Treboux J. (2019) Panorama del
mercado nacional e internacional de legumbres. AÑO XXXVII -N° Edición 1912, 28
de junio de 2019, Bolsa de Comercio de Rosario, Argentina.
Cattáneo R.M. (2020) Estimación y
predicción de segregantes transgresivos en poblaciones F2 provenientes de
hibridaciones entre líneas de arveja de diferentes orígenes geográficos. Tesis Doctoral, Universidad Nacional de Rosario, Rosario, Argentina.
Cazzola F., Bermejo C.J., Cointry
E. (2020) Transgressive segregations in two pea F2 populations and their
respective F2:3 families. Pesquisa Agropecuária Brasileira 55. doi: 10.1590/S1678-3921.pab2020.v55.01623.
Cazzola F., Bermejo C.J., Guindon
M.F., Cointry E. (2020) Speed breeding in pea (Pisum sativum L.), an efficient
and simple system to accelerate breeding programs. Euphytica 216, 178. doi.org/10.1007/s10681-020-02715-6.
Cobb J.N., Juma R.U., Biswas P.S.,
Arbelaez J.D., Rutkoski J., Atlin G., Hagen T., Quinn M., Ng E.W. (2019) Enhancing
the rate of genetic gain in public-sector plant breeding programs: lessons from
the breeder’s equation. Theor. Appl. Genet. 132: 627-645.
Collard B.C.Y., Beredo J.C., Lenaerts
B., Mendoza R., Santelices R., Lopena V., Verdeprado H., Raghavan C., Gregorio G.B.,
Vial L., Demont M., Biswas P.S., Iftekharuddaula K.F., Rahman K.A., Cobb J.N., Rafiqul
Islam M. (2017) Revisiting rice breeding methods-evaluating the use 384 of
rapid generation advance (RGA) for routine rice breeding. Plant Prod. Sci. 20: 337-352.
Cousin J.R., Massager A., Vingere
A. (1985) Breeding for yield in common peas. The peas Crops. In: Hebblethwaite P.H.,
Heath M.C., Dawkins T.C.K. (Eds.) Butterworths, pp. 115-129.
Coyne C., Kumar S., von Wettberg E.J.B.,
Marques E., Berger J.D., Redden R.J., Ellis T.H.N., Brus J., Zablatzká L., Smýka
P. (2020) Potential and limits of exploitation of crop wild relatives for pea,
lentil, and chickpea improvement. Legume Sci. e36. doi.org/10.1002/leg3.36.
Dahl W.J., Foster L.M., Tyler R.T.
(2012) Review of the health benefits of peas (Pisum sativum L.). British J
Nutrition 108: 3-10.
De Bernardi L. (2016) Informe de
Arvejas (Pisum sativum). Subsecretaría
de Mercados Agropecuarios. Buenos Aires Argentina, pp 13.
Dotas V., Bampidis V.A., Sinapis E.,
Hatzipanagiotou A., Papanikolaou K. (2014) Effect of dietary pea (Pisum sativum
L.) supplementation on growth performance, and carcass and meat quality of
broiler chickens. Livestock Sci. 164: 135-143.
Espósito M.A., Gatti I., Cointry E.
(2019) Construction and validation of core collections in Pisum sp. using
different methodologies. Legume Res. 42 (6): 743-749.
FAO. Food and Agriculture
Organization of the United Nations (2019) Faostat. Available at: http://www.fao.org/faostat/en/#data/QC/visualize
(Accessed on: Aug. 12, 2019).
Forster B.P., Herberle Bors E., Kasha
K.J., Touraev A. (2007) The resurgence of haploids in higher plants. Trends
Plant Sci. 12 (8): 368-375.
Gatti I., Guindón F., Bermejo C.,
Espósito A., Cointry E. (2016) In vitro tissue culture in breeding programs of
leguminous pulses: use and current status. Plant Cell Tiss. Organ. Cult. 127 (3):
543-559.
Germáná M.A. (2011) Anther
culture for haploid and doubled haploid production. Plant Cell Tiss. Organ Cult.
104: 283-300.
Goulden C.H. (1941) Problems in
plant selection. In: Proceedings of the 7th international congress genetics,
vol. 1039, pp. 132-133.
Grusak M.A. (2002) Enhancing
mineral content in plant food products. J. Am. Coll. Nutr. 21: 178S-183S.
Guindon M.F., Martin E., Cravero V.,
Cointry E.L. (2018) Transgressive segregation, heterosis and heritability for
yield-related traits in a segregating population of Pisum sativum L. Experimental
Agriculture, Cambridge University Press. pp. 1-11.
Gupta R.K., Gangoliya S.S., Singh
N.K. (2015) Reduction of phytic acid and enhancement of bioavailable
micronutrients in food grains. J Food Sci and Tech 52 (2): 676-684.
Hickey L.T., Hafeez A., Robinson H.,
Jackson S.A., Leal Bertioli S.C.M., Tester M., Gao C., Godwin I.D., Hayes B.J.,
Wulff B.B.H. (2019) Breeding crops to feed 10 billion. Nat. Biotechnol. 37 (7):
744-754. Doi:10.1038/s41587-019-0152-9.
Janzen J.P., Brester G.W., Smith V.H.
(2014) Dry peas: trends in production, trade, and price. Montana: Agricultural Marketing
Policy Center (AMPC. Briefing, 57).
Jones D.F. (1957) Gene action in
heterosis. Genetics 42: 93-101.
Lenaerts B., Collard B.C., Demont
M. (2019) Review: Improving global food security through accelerated plant
breeding. Plant Sci. 287: 110207. Doi: 10.1016/j.plantsci.2019.110207.
Liu H., Zwer P., Wang H., Liu C.,
Lu Z., Wang Y., Yan G. (2016) A fast generation cycling system for oat and
triticale breeding. Plant Breeding 135: 574-579. Doi: 10.1111/pbr.12408.
Maxted N., Ambrose N. (2000) Peas
(Pisum L.) Chapter 10. In: Maxted N., Bennett S.J. (Eds.) Plant Genetic
Resources of Legumes in the Mediterranean. Dordrecht: Kluwer Academic
Publishers, pp. 181-190.
Nagatoshi Y., Fujita Y. (2018) Accelerating
Soybean Breeding in a CO2- Supplemented Growth Chamber. Plant Cell Physiol. 60:
77-84.
Ochatt S.J., Sangwan R.S. (2010) In
vitro flowering and seed set: acceleration of generation cycles. In: Davey M.R.,
Anthony P. (Eds.) Plant Cell Culture: Essential Methods. Chichester: John Wiley
& Sons, pp. 97-110.
O’Connor D.J., Wright G.C., Dieters
M.J., George D.L., Hunter M.N., Tatnell J.R., Fleischfresser D.B. (2013) Development
and application of speed breeding technologies in a commercial peanut breeding
program. Peanut Sci. 40: 107-11.
Pandey M.K., Roorkiwal M., Singh V.K.,
Ramalingam A., Kudapa H., Thudi M., Chitikineni A., Rathore A., Varshney R.K. (2016)
Emerging Genomic Tools for Legume Breeding: Current Status and Future Prospects.
Front.Plant Sci. doi.org/10.3389/fpls.2016.00455.
Pratap A., Prajapati U., Singh C.M.
(2018) Potential, constraints and applications of in vitro methods in improving
grain legumes. Plant Breed. 137: 235-249.
Pratap A., Sethi G.S., Chaudhary H.K.
(2006) Relative efficiency of anther culture and chromosome elimination
techniques for haploid induction in triticale × wheat and triticale × triticale
hybrids. Euphytica
150: 339-345.
Prieto G.M., Vita E.A. (2010) El cultivo de
arveja. Informe técnico AER INTA Arroyo Seco. 5pp.
Prietto G.M. (2018) Arveja, una
alternativa para potenciar la secuencia de cultivos en la zona núcleo. https://www.clarin.com/rural/arveja-alternativapotenciar-secuencia-cultivoszona-nucleo_0_HJU8AUbGQ.html
(accesado Septiembre 2020).
SAGPyA (2010) https://www.argentina.gob.ar/agroindustria/agriculturaganaderia-y-pesca
(accesado September 2020).
Samineni S., Sen M., Sajja S.B., Gaur
P.M. (2019) Rapid generation advance (RGA) in chickpea to produce up to seven
generations per year and enable speed breeding. The Crop J. 8: 164-169.
Sarawat P., Stoddard F.L., Marshall
D.R., Ali R. (1994) Heterosis for yield and related characters in pea. Euphytica 80: 39-48.
Saxena K.B., Saxena R.K., Hickey L.T.,
Varshney R.K. (2019) Can a speed breeding approach accelerate genetic gain in
pigeonpea? Euphytica 215: 202. Doi: https://doi.org/10.1007/s10681-019-2520-4.
Sita K., Sehgal A., Hanumantha
Rao B. (2017) Food Legumes and Rising Temperatures: Effects, Adaptive
Functional Mechanisms Specific to Reproductive Growth Stage and Strategies to
Improve Heat Tolerance. Front.Plant Sci. 8: 1658. Doi: 10.3389/ fpls.2017.01658.
Smykal P., Kenicer G., Flavell A.J.,
Corander J., Kosterin O., Redden R.J., Ford R., Coyne C.J., Maxted N., Ambrose M.J.,
Ellis T.H.N. (2011) Phylogeny, phylogeography and genetic diversity of the
Pisum genus. Plant Genetic Res. 9: 4-18.
Smýkal P., Aubert G., Burstin J.,
Coyne C.J., Ellis N.T.H., Flavell A.J., Ford R., Hýbl M., Macas J., Neumann P.,
McPhee K.E., Redden R.J., Rubiales D., Weller J.L., Warkentin T.D. (2012) Pea
(Pisum sativum L.) in the genomic era. Agronomy 2: 74-115.
Smýkal P., Hradilová I., Trněný
O., Brus J., Rathore A., Bariotakis M., Das R.R., Bhattacharyya D., Richards C.,
Coyne C.J., Pirintsos S. (2017) Genomic diversity and macroecology of the crop
wild relatives of domesticated pea. Sci. Rep. 7 (1): 1-10.
Swaminathan M. (1988) Handbook of
food science and experimental foods. Bangalore: Bangalore Printing and
Publishing Co., Ltd, pp. 125-127.
Trněný O., Brus J., Hradilová
I. (2018) Molecular evidence for two domestication events in the pea crop. Genes
9 (11): 535. doi.org/10.3390/genes9110535.
Watson A., Ghosh S., Williams M.
(2018) Speed breeding is a powerful tool to accelerate crop research and
breeding. Nat. Plants 4: 23-29.
Zohary D., Hopf M. (2000) Domestication
of Plants in the Old World: The Origin and Spread of Cultivated Plants in West
Asia, Europe and the Nile Valley. Editorial Oxford University Press, UK.
Zong X., Yang T., Liu R., Zhu Z.,
Zhang H., Li L., Zhang X., He Y., Sun S., Liu Q., Li G., Guo R., Hu X., Shen B.,
Ma J., Zhang T. (2019) Chapter 6: Genomic Designing for Climate-Smart Pea. In: Genomic
Designing of Climate-Smart Pulse Crops. Chittaranjan Kole ed. New Delhi, India.
doi.org/10.1007/978-3-319-96932-9.



