Vol. XXXIII Issue 2
Article 5
DOI: 10.35407/bag.2022.33.02.05
ARTÍCULOS
ORIGINALES
Selección contra
displasia de cadera canina en el ovejero alemán
Breeding against canine hip dysplasia in the german shepherd dog
Poverene
M.M. 1 *
1 Departamento de Agronomía,
Universidad Nacional del Sur, Bahía Blanca, Argentina, Socia POA Núm. 19943.
Titular del criadero Vom Alderchen (Reg. 9689)
*
Corresponding author:
Monica Poverene mpoverene@gmail.com ORCID 0000-0003-2650-5894
RESUMEN
La
displasia de cadera canina o displasia coxo-femoral (DCF) es un desorden
progresivo e incapacitante en perros de razas grandes, como el Ovejero Alemán.
La selección de reproductores libres de displasia es la única forma de reducir
su incidencia. Se han desarrollado varios métodos de diagnóstico basados en el
examen radiográfico, en base a los cuales se seleccionan los reproductores para
la cría. La DCF tiene una base hereditaria poligénica e influencia ambiental,
con una heredabilidad media a baja (alrededor de 0,20 a 0,40), por lo que el
progreso de la selección fenotípica ha sido lento. En Argentina la prevalencia
de la displasia en la raza sigue siendo alta (>25%) y es imposible prever su
incidencia en la progenie del plantel de cría. Algunos países han implementado
la selección basada en el valor estimado de cría, obteniendo un importante
avance. Los estudios de asociación del genoma completo han revelado numerosos
marcadores asociados a la DCF y se han encontrado varios genes candidatos que
señalan la posibilidad de implementar una selección genómica en un futuro
cercano.
Key
words:
Displasia coxo-femoral, Ovejero Alemán, Selección fenotípica,
Selección genómica, Valor estimado de
cría
ABSTRACT
Canine hip dysplasia (CHD) is a
progressive and disabling disorder in large dog breeds, such as the German
Shepherd dog. Breeding sires and dams free of dysplasia is the only way to
reduce its incidence. Several diagnostic methods have been developed based on
radiographic examination, on the basis of which dogs are selected for breeding.
CHD has a polygenic hereditary basis and environmental influence, with a median
to low heritability (ca. 0,20 to 0,40), so the progress in phenotypic
selection has been slow. In Argentina, the prevalence of dysplasia in German
Shepherd dogs remains high (> 25%) and it is impossible to predict its
incidence in the offspring of the breeding stock. Some countries have implemented
a selection based on the estimated breeding value, obtaining an important
advance. Genomewide association studies have revealed numerous CHD-associated
markers and several candidate genes have been found that point to the
possibility of implementing genomic selection in the near future.
Palabras clave: Canine hip dysplasia, German
Shepherd dog, Phenotypic selection, Genomic selection, Estimated
breeding value
Received: 10/24/2022
Revised version received: 11/22/2022
Accepted: 11/23/2022
General
Editor:
Elsa Camadro
La
displasia de cadera es uno de los desórdenes musculo-esqueléticos más
frecuentes en los perros y fue descrita por primera vez en 1935 (Schnelle,
1959).
Displasia significa “crecimiento anormal” y es una alteración del desarrollo de
la articulación coxo-femoral. A diferencia de la humana, la displasia de cadera
canina no es congénita, sino que aparece durante el crecimiento (Ginja
et al., 2015).
El fenotipo está caracterizado por la laxitud de la articulación de la cadera
en perros jóvenes. Esa laxitud determina el movimiento lateral de la cabeza del
fémur fuera del acetábulo a medida que aumenta el peso del perro, lo que
produce un degaste anormal de las superficies óseas. Con la edad, tal condición
a menudo lleva al desarrollo de osteoartrosis y osteoartritis secundaria en una
o ambas caderas. La displasia coxofemoral (DCF) causa inestabilidad, dolor y
renguera clínica.
El
Ovejero Alemán es especialmente susceptible a la DCF, con riesgos de invalidez
y muerte por eutanasia que cuadriplican los de otras razas, probablemente debido
a su conformación y postura como también por ser una raza de trabajo en la que
la DCF no amerita el adiestramiento necesario (Zorko et al.,
2007;
Malm
et al. 2010).
La prevalencia de este desorden en la raza a nivel mundial es de 35% (Lewis
et al., 2013).
La DCF y la osteoartrosis son irreversibles y la única manera de aumentar el
bienestar de las razas afectadas es la selección de reproductores que no
presentan esta enfermedad.
Selección fenotípica
El
diagnóstico de DCF se basa en la observación de radiografías (Ginja
et al., 2010;
Butler
y Gambino, 2017).
La técnica radiográfica está estandarizada en todo el mundo (Flückiger,
2007a).
En el Ovejero Alemán la radiografía se realiza a partir de los 12 meses de
edad. El grado de displasia se determina en base al grado de distorsión de la
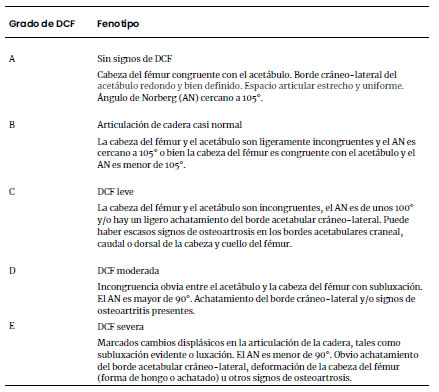
articulación coxo-femoral (Tabla 1). El criterio más importante es el ángulo de
Norberg, que se define por una recta que une los centros de las cabezas de
fémur derecha e izquierda y otra recta que une cada cabeza de fémur con el
borde craneal del acetábulo. Ese ángulo en una cadera normal mide unos 105°.
Tabla 1. Clasificación del
grado de displasia coxo-femoral (DCF) según la Federación Cinológica
Internacional (Modificado de Flückiger, 2007a)
El
método de evaluación de DCF propuesto en 1984 por la British Veterinary
Association (BVA) junto con el Kennel Club (KC, Reino Unido y
Australia), y adoptado por otros países, se basa en nueve caracteres visibles
en la radiografía, a los cuales se da un puntaje de 0 a 6 (donde 0 es normal y
6 es la condición más grave) a cada una de las caderas del perro. Esos
caracteres son: 1. Ángulo de Norberg; 2. Subluxación; 3. Borde acetabular craneal;
4. Borde acetabular dorsal; 5. Contorno acetabular craneal efectivo; 6. Fosa
acetabular; 7. Borde acetabular caudal; 8. Exostosis de la cabeza y cuello
femoral; 9. Recontorneado de la cabeza del fémur. El puntaje máximo es de 53
por cada cadera, o sea que 106 puntos es la peor calificación que puede obtener
un perro (Flückiger, 2007b). Debido a la
dificultad en cuantificar objetivamente los signos clínicos de la DCF, se han desarrollado
diversas escalas radiológicas para que los criadores puedan seleccionar los
perros más aptos para reproducción. Las más utilizadas son las de la Federación
Cinológica Internacional (FCI, Europa), BVA y KC, y la Orthopedic Foundation
for Animals (OFA, USA), pero, ya que consisten en evaluaciones subjetivas
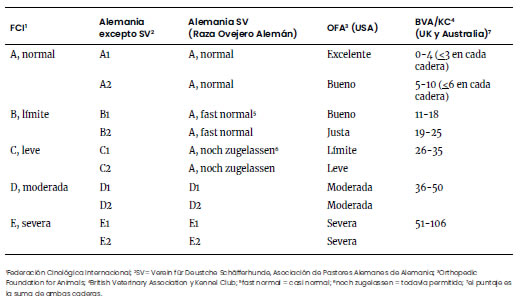
de las condiciones físicas del perro, no son fáciles de comparar (Tabla 2). El
Club Argentino de Criadores del Perro Ovejero Alemán (POA) utiliza la misma
escala que la Verein für Deustche Schäfferhunde (SV), la Asociación de
Pastores Alemanes de Alemania. Smith et al. (1990) introdujeron el
concepto de laxitud de cadera pasiva versus funcional para distinguir entre subluxación
evidente en la radiografía y la subluxación posterior inducida por la ganancia
de peso durante el crecimiento. Desarrollaron un método radiográfico de estrés
(radiografía de distracción) que en 1993 originó el Índice de dis-tracción
PennHIP (por el programa de mejoramiento de caderas de la Universidad de Pennsylvania,
EUA). Este índice ha resultado ser un mejor predictor de la DCF y la
osteoartrosis que el método de la FCI en varias razas, pero se ha utilizado limitadamente
en la raza Ovejero Alemán (Leighton et al.,
2019).
Tabla 2. Comparación de
distintos sistemas de clasificación de la displasia coxo-femoral, DCF
(Modificado de Flückiger, 2007b)
La
selección fenotípica en base al resultado radiográfico se implementó hace más
de 60 años (Ginja et al., 2015). La OFA estima que,
en promedio, solo el 5% de los perros de pedigrí se somete a examen
radiográfico (Reed et al. 2000). La radiografía es
obligatoria en pocos países (Alemania, Australia y Suecia), en la mayoría es voluntaria
y no hay requerimiento de control radiográfico en perros que no serán
destinados a cría, por lo que los valores promedio de DCF publicados no
reflejan el grado de prevalencia o severidad de la enfermedad dentro de una
raza (Soo y Worth, 2015). La DCF es considerada un carácter
cuantitativo porque puede ser medida y clasificada en grados, desde normal a
grave. Es un desorden multifactorial causado por herencia poligénica, factores
ambientales y probablemente epigenéticos (King, 2017; Ohlerth
et al., 2019).
La diferente expresión del desorden en las caderas derecha e izquierda es un
efecto no genético y siempre se clasifica al perro por el fenotipo de la peor
cadera.
Entre
los factores ambientales relacionados con la DCF se encuentran la alimentación,
la tasa de crecimiento y el ejercicio. La alta ingesta calórica, exceso de
proteínas y de calcio, alta tasa de crecimiento, el sobrepeso, el exceso de
ejercicio o ejercicios inadecuados son factores incidentes en perros con
predisposición genética, pero sin ella los factores ambientales por sí mismos
no pueden causar DCF. La castración temprana de hembras y machos también
favorece la aparición de displasia, mientras que la administración de
glucosaminaglucanos como polisulfatos, la previene (King,
2017).
Es notable que a partir del año 2000 en distintos países se observó un
mejoramiento significativo del efecto combinado de factores no genéticos
(alimentación, ejercicio) y este resultado favorable se debe a estrategias de
manejo exitosas de criadores, veterinarios y dueños de los perros.
Reed et al. (2000) analizaron la
influencia del padre, la madre e interacción padre x madre como factores
aleatorios sobre la variación en los puntajes de conformación de la cadera de
progenies de distintas razas. Tanto el macho como la hembra tuvieron un efecto significativo
en la herencia de la DCF, pero la interacción macho x hembra no resultó
significativa. Eso significa que la contribución genética del padre y de la
madre es igual en la determinación de este desorden. Sin embargo, un macho
puede transmitir sus características a un número mucho mayor de descendientes,
especialmente aquellos machos populares entre los criadores. La heredabilidad
estimada de la DCF puede variar según la muestra de perros que se considere, el
método de evaluación, la consanguinidad, los factores ambientales y el método
de cálculo. En el Ovejero Alemán las estimaciones son de 0,22-0,43 según la
OFA, 0,24-0,35 según la FCI y 0,30-0,35 según la BVA, aunque Leighton
et al. (2019)
han encontrado valores de heredabilidad mucho mayores (0,47 a 0,81). En un
estudio sobre más de 13 mil Ovejeros Alemanes en Australia se encontró que la
heredabilidad de los nueve caracteres analizados radiográficamente (método de
BVA, 1984, antes descrito) iba de 0,14 a 0,24, siendo más alta en los tres primeros
(0,23-0,24 para AN, subluxación y borde acetabular craneal) que en los
restantes. Los primeros tres parámetros se corresponden con los rasgos de laxitud
de la articulación y acetábulo poco profundo, mientras que los restantes se
relacionan con los cambios osteoartrósicos (Wilson et al.,
2012).
La
importancia práctica de dichas estimaciones de heredabilidad consiste en que,
siendo el rasgo heredable, sería posible disminuir su prevalencia a través de
la selección. Cuanto mayor sea la heredabilidad, mayor será el avance genético
que se obtendrá. La precisión de la selección fenotípica usando información del
propio individuo equivale a la raíz cuadrada de la heredabilidad, de modo que,
según los valores anteriores, la precisión de la selección estaría entre 0,47
(√0,22) y 0,65 (√0,43) si se consideran los valores estimados por
OFA. Este es un rango de valores similar al de los caracteres de producción del
ganado lechero, donde se ha obtenido un extraordinario avance genético en las
últimas décadas (Wilson et al., 2012). Varios autores han
señalado que a pesar de que el uso del examen radiográfico lleva más de 40
años, la prevalencia de la DCF permanece alta y han cuestionado los esquemas de
selección utilizados por la FCI, OFA y BVA. Si bien se ha reducido el número de
perros severamente afectados, ha habido sólo un progreso limitado en la reducción
del impacto total de la DCF (Leighton, 1997; Wilson et al.,
2011; Oberbauer et al., 2017; Ohlerth
et al. 2019;
Babá
et al., 2019;
James
et al., 2020).
En
la Figura
1 se
muestran los resultados de placas de cadera en Argentina durante los últimos 14
años (datos tomados de POA), calificadas de acuerdo al sistema establecido por
la SV alemana (Tabla 2). Las caderas Normal aumentaron un 10% y las Casi Normal
un 8% en ese período. Las categorías Grave y Mediana disminuyeron un 4%,
mientras que Todavía Permitido disminuyó un 11%. Eso implica que en ese período
la displasia disminuyó de 43 a 24%, incluyendo a los perros de esa última
categoría, a los que se permite competir y criar. Entre los criadores de todos
los países existe una difundida costumbre de realizar una radiografía no
oficial (llamada “preplaca”) y de acuerdo al resultado, proceder o no a
realizar la radiografía oficial. En consecuencia, es de esperar que la
prevalencia de la DCF en Argentina sea aún mayor del 24%. Las categorías
Mediana y Grave solo disminuyeron un 8%. Estos resultados podrían explicarse
porque hasta el año 2011 los machos autorizados para criar eran de las categorías
Normal, Casi Normal y Todavía Permitido, pero había todo tipo de hembras en el
plantel de cría (http://clubpoa.org.ar/busca-tu-cachorro/) y aún en 2019
figuraba alguna hembra Mediana. Ya que la DCF tiene una probabilidad de heredarse
de la misma forma tanto por parte del padre como de la madre, admitir hembras
con displasia en el plantel de cría determinaría un diferencial de selección
muy bajo. Desde diciembre 2019 solamente pueden criar los ejemplares con placa
de displasia A (Normal, Casi Normal y Todavía Permitido) según el Reglamento de
Crianza de POA (http://clubpoa.org.ar/reglamento-de-crianza-y-registro/). Aun
así, de acuerdo con la Tabla 2, Casi Normal equivale al 25% del puntaje de BVA,
y Todavía Permitido, al 33% de ese puntaje.
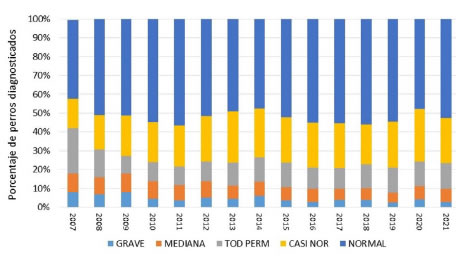
Figura 1. Frecuencia de las
categorías de displasia coxo-femoral (DCF) en el período 2007 - 2021 en el
Ovejero Alemán en Argentina. Datos tomados del Club Argentino de Criadores del
Perro Ovejero Alemán, POA (http://clubpoa.org.ar/estadisticas/). Las categorías
provienen del resultado de las placas radiográficas para el diagnóstico de DCF
y son: Normal, Casi normal, Todavía permitido, Mediana, Grave.
Selección basada en
el valor estimado de cría
Varios
autores sugieren que el progreso genético en DCF basado en los puntajes
radiográficos sería mucho más efectivo si la selección basada en el valor de
cría reemplazara a la selección fenotípica (Wilson et al.,
2012;
Lewis
et al., 2013;
Wilson y Nicholas, 2015; Leighton et al., 2019; Wang
et al., 2019).
El valor estimado de cría (en inglés, Estimated Breeding Value, EBV)
indica el valor de un perro como reproductor, para determinado rasgo. El EBV
se calcula a partir del fenotipo de un individuo, el de sus padres y sus
relaciones de pedigrí. El fenotipo de su progenie resulta más informativo que
el del individuo mismo, ya que perros con caderas normales pueden llevar alelos
que determinen DCF en sus descendientes. La observación de la progenie de ocho
campeones argentinos muestra que el fenotipo por sí solo no indica el riesgo de
transmitir la DCF a su progenie (Figura 2a). La descendencia
de los reproductores argentinos con más de 50 hijos diagnosticados, asumiendo
para todos ellos que las hembras que sirvieron son una muestra al azar en
cuanto a su fenotipo de DCF, muestra que es imposible predecir el resultado y
tampoco relacionarlo con el fenotipo del perro. Así, sumando los hijos Normal y
Casi Normal, un perro Casi Normal produjo una descendencia mejor en promedio
que algunos Normal, mientras que un perro Normal tuvo un resultado más pobre
que los Casi Normal y Todavía Permitido (Figura 2b). El análisis de
los datos de POA señala la imperiosa necesidad de implementar otro tipo de
selección en Argentina, ya que el riesgo de desarrollar DCF es muy alto para
una raza que en 2021 registró unos 3.300 cachorros de pedigrí, pero ha llegado
a registrar 10.000 una década atrás (http://clubpoa.org.ar/busca-tucachorro/listado-de-servicios-y-nacimientos).
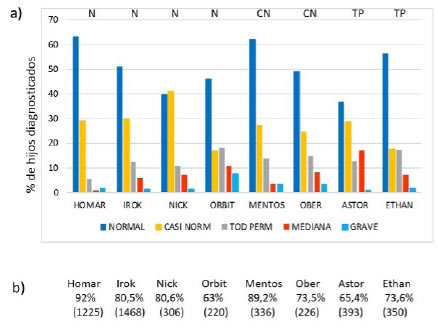
Figura 2. a) Clasificación de
la descendencia de reproductores con más de 50 hijos diagnosticados. Datos
tomados del Club Argentino de Criadores del Perro Ovejero Alemán, POA (http://clubpoa.org.ar/estadisticas/).
Sobre cada reproductor figura su propia calificación del grado de displasia
coxo-femoral (DCF): N= Normal, CN= Casi Normal, TP= Todavía Permitido; b)
Porcentaje de hijos Normal y Casi Normal correspondiente a cada reproductor.
Entre paréntesis figura el número de hijos diagnosticados.
La
dificultad del avance genético con base solamente en el fenotipo del individuo
reafirma que la selección sería mucho más efectiva basada en el valor de cría,
o sea si la selección genotípica reemplazara a la selección fenotípica. En
Australia comenzó a aplicarse este método en 1980 basado en el índice PennHIP
de dis-tracción, antes descrito, teniendo en cuenta el puntaje individual del
perro, el de todos los medios hermanos paternos y maternos y el de toda su
progenie, si la había. Sobre más de 5.200 Ovejeros Alemanes, en la generación 7
más del 97% tenía caderas calificadas como Excelente (Leighton
et al., 2019).
En Alemania, la SV comenzó a aplicar la selección basada en EBV en 1998,
tomando en cuenta al individuo, sus padres y su progenie más un factor de
ponderación que incluye factores genéticos, de género (hembra o macho), de
ambiente y de heredabilidad que permiten corregir la información fenotípica.
Para cada ejemplar se obtiene un número de Zuchtwert (HD ZW) o estimación del
valor de cría para DCF, que es público y permite a los criadores elegir un
reproductor (https://www.sv-doxs.net/). En esta raza se calcula que la
selección basada en EBV ha sido tres veces más efectiva que la selección
fenotípica en términos de progreso genético (Stock et al.,
2011;
Soo
y Worth, 2015).
Este hecho es importante porque Alemania tiene una población superior a 450.000
perros registrados y exporta reproductores a todos los países. Suecia y
Finlandia también han implementado la selección basada en EBV en la raza
Ovejero Alemán desde 2012 (Hedhammar, 2020).
Hacia una Selección
genómica
Desde
2004 se dispone de la secuencia de un genoma canino de referencia (Ostrander
y Wayne, 2005;
https://research.nhgri.nih.gov/dog_genome/) abriendo la posibilidad de
identificar los genes responsables de la DCF (Guo et al.,
2011).
Cada raza investigada ha mostrado diferentes mutaciones asociadas con la
displasia (Zhou et al., 2010; Oberbauer
et al., 2017).
El uso de distintas escalas para el fenotipado y el escaso número de perros diagnosticados
con respecto a la población general han dificultado el análisis de los genes
involucrados (Stock et al. 2011).
Janutta et al. (2006) encontraron
evidencia de un gen mayor, con escasa influencia ambiental, responsable del desarrollo
de DCF en el Ovejero Alemán. Estos autores estudiaron 20 familias de Ovejeros
Alemanes durante varias generaciones, incluyendo más de 8.500 perros, encontrando
que el modelo que mejor ajustó a los datos fue una combinación de genes mayores
con poligenes. Esto explicaría la dificultad en erradicar esta dolencia. Los
primeros estudios de asociación del genoma completo (GWAS) en la raza se
realizaron en Alemania, ya que la SV dispone de estudios radiográficos, muestras
de ADN y registros completos de pedigrí de un gran número de ejemplares.
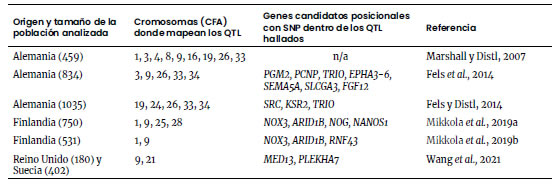
Marshall y Distl (2007) hallaron QTL asociados con la DCF en nueve de los 39
pares de cromosomas (Tabla 3). Posteriormente, 19 QTL pudieron relacionarse con
distintos genes candidatos (Fels y Distl, 2014; Fels et al. 2014).
Diez de esos genes están relacionados entre sí y constituyen una red asociada a
la formación de hueso y cartílago. Otro gen en el cromosoma 24 asociado a las
diferencias entre perros libres de DCF y afectados con grados C a E (Tabla 2),
está relacionado con la formación de hueso (Fels y Distl, 2014). Mikkola
et al. (2019a)
encontraron dos SNP en el cromosoma canino (CFA) 1 y otros dos en el CFA 9
cuyos alelos se corresponden con fenotipos libres o leves de DCF, o bien con
fenotipos de DCF moderada a severa. En el CFA 9 uno de ellos coincide con el
gen NOG, que codifica una proteína necesaria para el desarrollo del tubo
neural y para la condrogénesis, osteogénesis y formación de articulaciones en
el embrión. NOX3 en el CFA 1 es un gen candidato para la degradación del
cartílago articular. Las variantes en el CFA 1 se asociaron a la presencia o
ausencia de signos radiográficos de osteoartrosis, mientras que loci en los CFA
9 y 28 se correspondieron con signos de incongruencia de la articulación de la
cadera (Mikkola et al., 2019b). Sin embargo, asociaciones entre
distintos fenotipos de displasia y numerosos SNP en poblaciones de Ovejeros Alemanes
del Reino Unido, Suecia y Finlandia confirman la naturaleza genética compleja
de la DCF, con múltiples loci asociados al rasgo (Wang et al.,
2021).
Cuatro SNP con asociación significativa con la DCF resultaron comunes a
varias razas estudiadas (entre ellos, dos en los CFA 1 y 26 descritos en el
Ovejero Alemán, Tabla 3) pero muchas más asociaciones significativas con SNP se
encontraron dentro de cada raza (Mikkola et al., 2021) confirmando la
arquitectura genética compleja de la DCF y del genotipo de todos los genes
relacionados con ella en las diversas razas.
Tabla 3. QTL y genes
candidatos asociados con fenotipos de displasia coxo-femoral descritos por el
método de FCI en el Ovejero Alemán.
La
selección genómica se basa en un análisis de ADN que provea ciertos marcadores
en desequilibrio de ligamiento con genes asociados con la DCF. Ya que el
análisis puede realizarse al nacimiento, la selección genómica representaría un
avance comparada con la selección basada en EBV (Sánchez
Molano et al., 2014). En la raza Labrador se ha desarrollado un modelo
basado en siete polimorfismos genéticos con alto valor predictivo para la
detección temprana de la DCF; seis de estos SNP se han localizado en genes candidatos
relacionados con el metabolismo de la matriz extracelular y con el metabolismo
del hueso (Bartolomé et al. 2015) y coinciden con los
genes candidatos hallados en el Ovejero Alemán por Fels y Distl (2014). También se ha
investigado el tamaño de la población de referencia que permitiría aplicar la
selección genómica en la raza Labrador (Edwards et al.,
2018).
El modelo predictivo de DCF desarrollado por Bartolomé et al. (2015)
para la raza Labrador no ha sido probado en otras razas. Los QTL que
influencian la DCF en el Ovejero Alemán han mostrado convergencia en su
ubicación en diversos estudios. Disponer de marcadores en desequilibrio de
ligamiento con esos genes permitiría caracterizar cada uno de los grados de DCF
en una población de referencia y desarrollar una ecuación predictiva, que se
aplicaría luego al diagnóstico de reproductores y camadas (Figura 3). La ecuación
predictiva permitiría realizar un diagnóstico de DCF con base en los marcadores
de ADN en una edad temprana, sin necesidad de esperar 12 meses para evaluar
radiográficamente al ejemplar, y determinar su valor de cría genómico (GEBV).
El reto que queda es la identificación de las mutaciones que colectivamente sustentan
la DCF y la osteoartrosis para entender la patogenia molecular de estas
enfermedades. Cuando los genes que más significativamente influyen en esta
dolencia sean localizados mediante marcadores moleculares, la selección
genómica será una alternativa valiosa para la raza Ovejero Alemán.
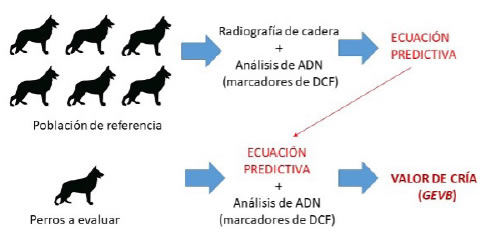
Figura 3. Esquema de los pasos
a seguir para obtener el valor de cría (GEVB) necesario para realizar una
selección genómica en contra de la displasia coxo-femoral (DCF) en la raza
Ovejero Alemán. La ecuación predictiva daría valores a cada uno de los
fenotipos de DCF, desde Normal a Grave.
BIBLIOGRAFÍA
Babá
A., Lopes de Oliveira C., Yoshida G., Cavalcante Costa M., Bueno Ribeiro L., Souza
Vasconcellos R. (2019) Heritability of hip dysplasia: Preliminary results for
German Shepherd dogs in Brazil. Prevent. Vet. Med. 171: 104745. doi: 10.1016/j.prevetmed.2019.104745
Bartolomé
N., Segarra S., Artieda M., Francino O., Sánchez E., Szczypiorska M., et al.
(2015) A Genetic Predictive Model for Canine Hip
Dysplasia: Integration of Genome Wide Association Study (GWAS) and Candidate
Gene Approaches. PLoS ONE 10(4): 0122558. doi: 10.1371/journal.pone.0122558
Butler J., Gambino J. (2017) Canine
Hip Dysplasia. Diagnostic Imaging. Vet. Clin. Small Anim. 47: 777-793. doi: 10.1016/j.cvsm.2017.02.002
Edwards S., Woolliams J., Hickey J.,
Blott S., Clements D., Sánchez- Molano E., Todhunter R., Wiener P. (2018) Joint
Genomic Prediction of Canine Hip Dysplasia in UK and US Labrador Retrievers. Front.
Genet. 9:101. doi: 10.3389/fgene.2018.00101
Fels L., Distl O. (2014) Identification
and Validation of Quantitative Trait Loci (QTL) for Canine Hip Dysplasia (CHD)
in German Shepherd Dogs. PLoS ONE 9(5): e96618. doi: 10.1371/journal.pone.0096618
Fels L., Marschall Y., Philipp U.,
Distl O. (2014) Multiple loci associated with canine hip dysplasia (CHD) in
German shepherd dogs. Mamm. Genome 25: 262-269. doi: 10.1007/s00335-014-9507-1
Flückiger M. (2007a) How to take
and read hip joint radiographs in a structured way. Eur. J. Companion Anim.
Pract. 17(2): 133-134.
Flückiger M. (2007b) Scoring
radiographs for canine Hip Dysplasia - The big three organisations in the world. Eur. J. Companion Anim. Pract. 17(2): 135-140.
Ginja M., Silvestre A., Gonzalo-Orden
J., Ferreira A. (2010) Diagnosis, genetic control and preventive management of
canine hip dysplasia: A review. Veter. J. 184: 269-276. doi: 10.1016/j.tvjl.2009.04.009
Ginja M., Gaspar A., Ginja C. (2015)
Emerging insights into the genetic basis of canine hip displasia. Veterinary
Medicine: Research and Reports, 6: 193-202.
Guo G., Zhou Z., Wang Y., Zhao K.,
Zhu L., Lust G., Hunter L., Friedenberg S., Li J. et al. (2011) Canine
hip dysplasia is predictable by genotyping. Osteoarthritis and Cartilage, 19: 420e429.
doi: 10.1016/j. joca.2010.12.011
Hedhammar A. (2020) Swedish
Experiences from 60 Years of Screening and Breeding Programs for Hip Dysplasia-Research,
Success, and Challenges. Front. Vet. Sci. 7: 228. doi: 10.3389/fvets.2020.00228
James H., McDonnell F., Lewis T.
(2020) Effectiveness of Canine Hip Dysplasia and Elbow Dysplasia Improvement
Programs in Six UK Pedigree Breeds. Front. Vet.
Sci. 6: 490. doi: 10.3389/fvets.2019.00490
Janutta V., Hamann H., Distl O. (2006)
Complex Segregation Analysis of Canine Hip Dysplasia in German Shepherd Dogs. J.
Hered. 97(1): 13- 20. doi: 10.1093/jhered/esi128
King M. (2017) Etiopathogenesis
of Canine Hip Dysplasia, Prevalence, and Genetics. Vet. Clin. North Am. Small
Anim. Pract. 47(4): 753-767. doi: 10.1016/j.cvsm. 2017.03.001
Leighton E. (1997) Genetics of
canine hip dysplasia. A Review. J. Am. Vet. Med. Assoc. 210(10): 1474-1479.
Leighton E.A., Holle D., Biery D.,
Gregor T., McDonald-Lynch M., Wallace M., et al. (2019) Genetic
improvement of hip-extended scores in 3 breeds of guide dogs using estimated
breeding values: Notable progress but more improvement is needed. PLoS ONE, 14(2): e0212544. doi: 10.1371/journal.pone.0212544
Lewis T., Blott S., Woolliams J.
(2013) Comparative analyses of genetic trends and prospects for selection
against hip and elbow dysplasia in 15 UK dog breeds. BMC Genetics, 14: 16. doi:
10.1186/1471-2156-14-16
Malm S., Fikse F., Egenvall A., Bonnett
B., Gunnarsson L., Hedhammar A., Strandberg E. (2010) Association between
radiographic assessment of hip status and subsequent incidence of veterinary
care and mortality related to hip dysplasia in insured Swedish dogs. Preven. Veter.
Med. 93: 222 -232. doi: 10.1016/j. prevetmed.2009.09.017
Marschall Y., Distl O. (2007) Mapping
quantitative trait loci for canine hip dysplasia in German Shepherd dogs. Mamm.
Genome 18:861-870. doi: 10.1007/s00335-007-9071-z
Mikkola L., Holopainen S., Lappalainen
A., Pessa-Morikawa T., Augustine T., Arumilli M., et al. (2019a) Novel
protective and risk loci in hip dysplasia in German Shepherds. PLoS Genet. 15 (7):
e1008197. doi: 10.1371/journal.pgen.1008197
Mikkola L., Holopainen S., Pessa-Morikawa
T., Lappalainen A., Hytönen M., Lohi H., Iivanainen A. (2019b) Genetic
dissection of canine hip dysplasia phenotypes and osteoarthritis reveals three
novel loci. BMC Genomics, 20: 1027. doi: 10.1186 /s12864-019-6422
Mikkola L., Kyöstilä K., Donner J.,
Lappalainen A., Hytönen M., Lohi H., Iivanainen A. (2021) An across-breed
validation study of 46 genetic markers in canine hip dysplasia. BMC Genomics, 22: 68. doi: 10.1186/s12864-021-07375-x
Oberbauer A., Keller G., Famula T.
(2017) Longterm genetic selection reduced prevalence of hip and elbow dysplasia
in 60 dog breeds. PLoS ONE, 12(2): e0172918.
doi: 10.1371/journal.pone.0172918
Ohlerth S., Geiser B., Flückiger M.,
Geissbühler U. (2019) Prevalence of Canine Hip Dysplasia in Switzerland Between
1995 and 2016-A Retrospective Study in 5 Common Large Breeds. Front. Vet. Sci. 6: 378. doi: 10.3389/fvets.2019.00378
Ostrander E., Wayne R. (2005) The
canine genome. Genome Res. 15: 1706-1716. doi: 10.1101/gr.3736605
Reed A., Keller G., Vogt D., Ellersieck
M., Corley M. (2000) Effect of dam and sire qualitative hip conformation scores
on progeny hip conformation. J. Am. Vet. Med.
Assoc. 217(5): 675-680.
Sánchez-Molano E., Woolliams J., Blott
S., Wiener P. (2014) Assessing the impact of genomic selection against hip
dysplasia in the Labrador Retriever dog. J. Anim. Breed. Genet. 131: 134-145.
doi:10.1111/jbg.12056
Schnelle G. (1959) Congenital
dysplasia of the hip in dogs. J. Am. Vet. Med.
Assoc. 135(4): 234-235.
Smith G., Biery D., Gregor T. (1990)
New concepts of coxofemoral joint stability and the development of a clinical
stressradiographic method for quantitating hip joint laxity in the dog. J. Am. Vet. Med. Assoc. 196: 59-70.
Soo M., Worth A. (2015) Canine
hip dysplasia: phenotypic scoring and the role of estimated breeding value
analysis. New Zealand Veter. J . 63:2, 69-78.
doi: 10.1080/00480169.2014.949893
Stock K., Klein S., Tellhelm B., Distl
O. (2011) Genetic analyses of elbow and hip dysplasia in the German shepherd
dog. J. Anim. Breed. Genet. 128: 219-229.
Wang S., Strandberg E., Viklund A.,
Windig J., Malm S., Lewis T., Laloë D., Leroy G. (2019) Genetic improvement of
canine hip dysplasia through sire selection across countries. Veter. J. 248: 18-24. doi: 10.1016/j.tvjl.2019.03.009
Wang S., Strandberg E., Arvelius P.,
Clements D., Wiener P., Friedrich J. (2021) Genomewide association studies for
canine hip dysplasia in single and multiple populations - implications and
potential novel risk loci. BMC Genomics, 22: 636.
doi: 10.1186/s12864-021-07945-z
Wilson B., Nicholas F., Thomson P.
(2011) Selection against canine hip dysplasia: Success or failure? Veter. J. 189: 160-168.
Wilson B., Nicholas F., James J.,
Wade C., Tammen I., Raadsma H., Castle K., Thomson P. (2012) Heritability and
Phenotypic Variation of Canine Hip Dysplasia Radiographic Traits in a Cohort of
Australian German Shepherd Dogs. PLoS ONE, 7(6):
e39620. doi: 10.1371/journal.pone.0039620
Wilson B., Nicholas F. (2015) Canine
hip dysplasia - towards more effective selection. New Zealand Veter. J. 63(2): 67-68.
doi: 10.1080/00480169.2015.985562
Zhou Z., Sheng X., Zhang Z., Zhao
K., Zhu L., et al. (2010) Differential Genetic Regulation of Canine Hip
Dysplasia and Osteoarthritis. PLoS ONE, 5(10): e13219.
doi: 10.1371/journal.pone.0013219
Zorko B., Ivanusa T., Pelc R. (2007)
Progression of Hip Dysplasia in 40 Police working dogs.
Eur. J. Companion Anim. Pract. 17(2): 145- 148.



